Ein Kilo Lithium für nur fünf Dollar? Eine spezielle Membran soll es möglich machen.
Lithium für die Batterien von Elektroautos ist ein dringend benötigter Rohstoff, und im Meerwasser ist das Element in Hülle und Fülle vorhanden – wenn auch in verschwindend geringen Konzentrationen. Elektrochemiker an der saudi-arabischen King Abdullah University of Science and Technology (KAUST) haben nun eine Methode gefunden, die Konzentration deutlich zu heben. So könnte Lithium künftig auch aus Meerwasser gewonnen werden.
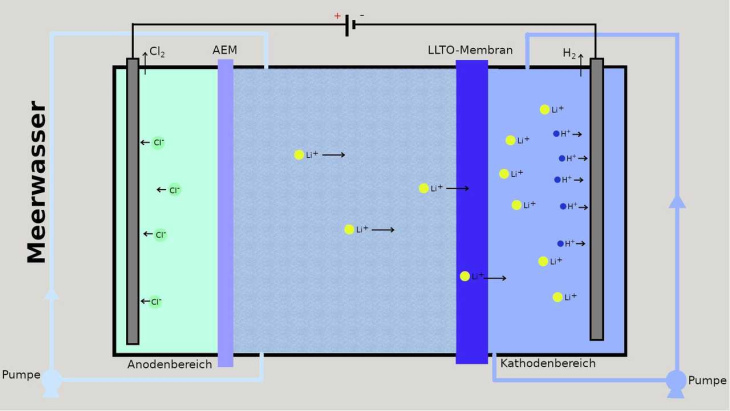
Sie dient als Sieb für die Ionen: Die nur 107 Picometer großen Lücken in dem LLTO-Kristallgitter sind eigentlich für die 118 Picometer großen Lithium-Ionen zu groß, doch durch thermische Schwingungen des Gitters gelangen sie dennoch hindurch. Größere Ionen wie Na+ oder Mg2+ werden hingegen zurückgehalten, so der Postdoc-Forscher Zhen Li.
Um die positiv geladenen Ionen durch das Gitter zu kriegen, ist aber noch etwas Nachhilfe nötig; die kommt von einer negativ geladenen Kathode, welche die Lithium-Kationen durch ihre Anziehungskraft sozusagen durch die Membran saugt. Entladen wird jedoch nicht Lithium (wie im Lithium-Ionen-Akku), sondern Wasserstoff, denn Protonen sind im Meerwasser natürlich in Mengen enthalten, und sie gelangen ebenfalls durch die Membran. Immerhin wird so Wasserstoff als Nebenprodukt gewonnen, der verkauft werden kann.
Die Forscher verwenden eine Anordnung mit drei Kammern. In der Mitte strömt das Meerwasser hindurch, links befindet sich eine konventionelle Anionen-Austausch-Membran (AEM), die die Chlorid-Ionen in den Bereich der Standard-Anode durchlässt. Rechts befindet sich hinter der LLTO-Membran die Kathode.
Im Meerwasser beträgt die Konzentration von Lithium nach den Forschern nun etwa 0,2 ppm, das heißt, 0,00002 Prozent. Die neue Methode erhöht die Konzentration um das 43.000-Fache auf etwa 9.000 ppm (0,9 Prozent). Dazu sind insgesamt fünf Durchgänge nötig, bei denen immer wieder der Inhalt der rechten Kammer entnommen und als neues Ausgangsmaterial verwendet wird. So erhöht sich die Konzentration in der Kathodenbereich immer weiter.
Ist mit dieser Methode nun die Lithium-Versorgung für alle Zeiten gesichert? Natürlich nicht. Ein Laborexperiment im Milliliter-Maßstab ist natürlich noch lange kein industrieller Prozess. So mussten die Forscher nicht nur die LLTO-Membran aufwendig selbst herstellen und prüfen, und auch die hohle Kupferkathode mit durchperlendem CO2 ist kein Standardprodukt. Hinzu kommt die aufwendige Prozessführung mit dem Auswechseln der Salzlösungen.
Aber wir wollen die Entdeckung nicht klein reden, denn jeder Prozess der Chemieindustrie hat im Labor begonnen. Außerdem haben sich die Forscher auch schon ein wenig Gedanken zur Wirtschaftlichkeit gemacht. Den Stromverbrauch geben sie mit 76 kWh pro Kilo Lithium an. An der Ladesäule kosten 76 kWh relativ viel, aber mit US-Industriestrom zu 6,5 Cent pro Kilowattstunde landet man bei nur fünf Dollar pro Kilo Lithium.
Quelle: Energy & Environmental Science via Electrive.net



























































